
发布时间:2024-05-07 阅读:2917
光动力疗法(PDT)是一种新兴的治疗模式,它是一种非侵入性癌症治疗方法,它利用光敏剂和特定波长的光来杀死癌细胞。光敏剂被激活后可以产生一种高度活性的分子氧(单线态氧,ROS)或其他氧化物质,进而导致细胞死亡。目前的PDT主要用于治疗皮肤及表层组织的肿瘤,这是因为传统PDT所用的光敏剂主要是对可见光敏感的,但由于大部分生物分子都会吸收可见光,导致其光穿透生物组织的能力有限,减少了其在治疗深层肿瘤方面的功效。近红外(NIR)光源提供了一种解决方案,它在700-1700纳米的NIR窗口波长范围内被生物组织较少吸收,因此能更深入地穿透组织。NIR光的这种穿透能力意味着它可以更有效地到达深部肿瘤位置,并激活光敏剂进行治疗。
为了解决PDT中光穿透深度不足的问题,上转换纳米颗粒(UCNPs)成为了研究的热点。这些颗粒通过对其成分、结构和表面功能化进行精细调控,可以制备出具备多种性质的UCNPs来提升其性能。例如,将稀土元素如铒、镓和钇掺杂进UCNPs可以实现将近红外光转换为可见光的多种上转换发光。在PDT应用中,UCNPs通过将近红外光转换为能量更高的可见光或紫外光,从而能够深入组织并在光敏剂的最佳激活波长下产生疗效。此外,UCNPs与光敏剂的结合是关键一环,因为这直接关系到ROS的产生效率。在各种光敏剂当中,卟啉(PPIX)以其优良的光物理性质、生物相容性和适用性成为研究的焦点,同时卟啉类物质也是目前临床上应用最广泛的光敏剂。然而目前的研究仍面临挑战,例如UCNPs携带的光敏剂量有限且稳定性较差,UCNPs缺乏精准靶向肿瘤部位的能力。
在本研究中,我们成功合成了PPIX-PEI-UCNP@FA纳米颗粒,这是一种由PPIX分子、掺杂镱(Yb)和铒(Er)的UCNPs、PEI和叶酸(FA)组成的新型复合材料。传统的UCNPs PEI改性通常依赖于表面涂层,但这种方法未能利用PEI的空间结构来提高药物载量和光吸收效率。在我们的研究中,利用富含氨基的高支化度PEI连接表面双功能化的UCNPs,我们构建了一个以UCNPs为核的空间纳米球结构,形成高比表面积,同时实现了高达0.69 wt.%的PPIX负载率,并利用氨基有效降低了PEI的毒性。UCNPs能将激发波长延伸至980 nm,以实现超过10 mm的治疗穿透深度。PEI的高分支结构增加了PPIX的负载量,进而能有效产生ROS并显著提高肿瘤细胞杀伤率。通过FA的功能化,药物可以特异性地运送至癌细胞。在体内实验中,经静脉注射的纳米颗粒与肿瘤细胞膜上的FA受体结合并内化,在980 nm激光照射下,材料在深层肿瘤组织中产生大量ROS,使线粒体膜电位降低、功能损害,并减少ATP产生,导致细胞凋亡,最终在小鼠体内实现了超过10 mm深层肿瘤的良好杀伤效果,为深层PDT治疗提供了一个新的选择。
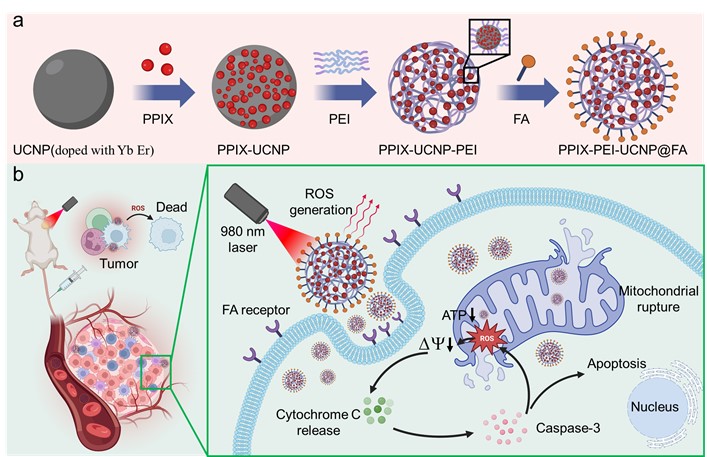
图 (a) PPIX-PEI-UCNP@FA NPs合成方案 (b) 利用PPIX-PEI-UCNP@FA NPs进行PDT治疗肿瘤的作用机制。
该工作被发表在“Hongrui Shan, Xueqian Wang, Qiheng Wei, Hailang Dai, and Xianfeng Chen, Enriched endogenous photosensitizer for deep-seated tumors photodynamic therapy, Photonics Research, 12(5), 1024-1035 (2024)”.
原文链接: https://opg.optica.org/prj/fulltext.cfm?uri=prj-12-5-1024&id=549486